Valneva vaccine le premier participant de l’étude pédiatrique
portant sur son vaccin à dose unique contre le chikungunya
Saint-Herblain (France), 10 janvier
2024 - Valneva SE (Nasdaq : VALN ; Euronext Paris : VLA) a
annoncé aujourd'hui la vaccination du premier participant à son
étude clinique de Phase 2 évaluant l'innocuité et l'immunogénicité
de deux doses différentes de son vaccin à injection unique contre
le chikungunya chez l'enfant. Valneva avait annoncé, il y a deux
mois, des résultats positifs pour l'étude-pivot de Phase 3 chez les
adolescents, confirmant l'immunogénicité et le profil d'innocuité
observés chez les adultes1.Il n'existe actuellement aucun vaccin
approuvé contre le chikungunya pour les enfants, et le vaccin
IXCHIQ® de Valneva est actuellement le seul vaccin contre le
chikungunya à avoir reçu une autorisation2 pour répondre à ce
besoin médical non satisfait chez les personnes âgées de 18 ans et
plus présentant un risque accru d'exposition au virus. Une fois
disponibles, les données pédiatriques de Phase 2 pourraient
permettre de lancer une étude-pivot de Phase 3 chez l'enfant avec
pour objectif de permettre de futures demandes réglementaires pour
cette tranche d'âge après l’obtention d’autorisations
réglementaires initiales chez l'adulte et potentiellement chez
l'adolescent.
L'étude clinique prospective de Phase 2,
multicentrique, randomisée et en double aveugle, devrait inclure
environ 300 enfants en bonne santé, âgés d’un à onze ans répartis
sur trois sites d’essais cliniques se trouvant en République
Dominicaine et au Honduras. Après une phase d'évaluation de
l'innocuité, les participants seront randomisés pour recevoir soit
une dose complète du vaccin (120 participants), soit une demi-dose
(120 participants), soit un vaccin témoin (60 participants).
Juan Carlos Jaramillo M.D., Chief
Medical Officer de Valneva, a indiqué, « Cette étude
pédiatrique est extrêmement importante. Compte tenu de la menace
significative que représente le chikungunya pour les personnes
vivant ou voyageant dans des zones endémiques, il est crucial de
rendre le vaccin accessible à tous les groupes d'âge. Nous pouvons
ainsi renforcer la protection contre cette maladie débilitante et
en réduire les effets. »
Valneva a reçu une autorisation de mise sur le
marché de la FDA américaine pour son vaccin contre le chikungunya
IXCHIQ® en novembre 20233. Trois demandes d’autorisation de mise
sur le marché font actuellement l’objet d’un examen par l'Agence
Européenne des Médicaments, Santé Canada et l’agence de santé
brésilienne Anvisa, avec des autorisations potentielles attendues
en 2024.
À propos de chikungunyaLe
chikungunya est une maladie virale transmise par les moustiques
Aedes, causée par le virus du chikungunya (CHIKV), un virus de la
famille des Togaviridae. L’infection au virus du chikungunya
provoque une maladie clinique chez jusqu’à 97% des personnes dans
les quatre à sept jours qui suivent la piqûre du moustique4. Si la
mortalité due au virus est faible, la morbidité est élevée, et le
marché mondial des vaccins contre le chikungunya est estimé à plus
de $500 millions par an d'ici 20325. Les symptômes cliniques
incluent fièvres aigües, douleurs invalidantes aux niveaux des
articulations et des muscles, ainsi que des maux de tête, nausées,
rougeurs et des arthralgies chroniques. Le virus du chikungunya
provoque souvent des épidémies soudaines avec des taux d'attaque
élevés, touchant un tiers à trois quarts de la population dans les
zones où le virus circule. Les zones d’infection les plus à risque
pour les voyageurs sont celles où les moustiques porteurs du virus
du chikungunya sont endémiques, notamment en Amérique, dans
certaines parties de l'Afrique et de l'Asie du Sud-Est, et le virus
s'est répandu dans plus de 110 pays6. Entre 2013 et 2023, plus de
3,7 millions de cas ont été signalés sur le continent américain7 et
l’impact économique de la maladie est considéré comme extrêmement
important. Cet impact devrait continuer à s’alourdir alors que les
principaux vecteurs du virus ne cessent d’étendre leur territoire.
Avant IXCHIQ®, il n’existait aucun vaccin préventif, ni traitement
efficace contre chikungunya qui est, de ce fait, considéré comme
une menace majeure pour la santé publique.
Afin de rendre le vaccin accessible dans les
pays à revenus faibles et intermédiaires, Valneva et l’Institut
Butantan ont signé en janvier 2021 un contrat pour le
développement, la production et la commercialisation de VLA15538.
La collaboration s’inscrit dans le cadre du contrat de financement
de $24,6 millions que Valneva a conclu avec la Coalition pour les
Innovations en Préparation aux Epidémies (CEPI) en juillet 20199,
avec le soutien du programme Horizon 2020 de l’Union
Européenne.
À propos
d'IXCHIQ®Aux États-Unis, IXCHIQ® est un
vaccin vivant atténué indiqué pour la prévention de la maladie
causée par le virus du chikungunya (CHIKV) chez les personnes âgées
de 18 ans et plus présentant un risque accru d'exposition au CHIKV.
Comme pour tous les produits approuvés dans le cadre de la
procédure d'autorisation accélérée de la FDA, le maintien de
l'autorisation pour cette indication est subordonné à la
vérification du bénéfice clinique dans un ou plusieurs essais de
confirmation.
À propos de l’étude de Phase 2
VLA1553-221VLA1553-221 est une étude de Phase 2
multicentrique, randomisée, en double aveugle, incluant environ 300
enfants en bonne santé âgés d’un à onze ans. L’étude est menée en
République dominicaine et potentiellement au Honduras. Les critères
principal et secondaire de l'étude sont d'évaluer l’innocuité et
l'immunogénicité de deux doses différentes du vaccin à injection
unique de Valneva contre le chikungunya. Des informations
supplémentaires, y compris une description détaillée de la
conception de l'étude, des critères d'éligibilité et des sites
d'investigation, sont disponibles sur ClinicalTrials.gov
(Identifiant : (NCT06106581).
À propos de Valneva SEValneva
est une société spécialisée dans le développement, la production et
la commercialisation de vaccins prophylactiques contre des maladies
infectieuses générant d’importants besoins médicaux. Valneva a une
approche hautement spécialisée et ciblée et utilise son expertise
dans les différents modes de vaccination pour développer des
vaccins contre des maladies pour lesquelles ils n’existent pas
encore de vaccins ou pour lesquelles les solutions existantes
peuvent être améliorées.
Nous disposons d'une solide expérience en
R&D, ayant fait progresser plusieurs vaccins des premiers
stades de la recherche jusqu'à leur mise sur le marché. Nous
commercialisons actuellement deux vaccins du voyage ainsi que
certains vaccins de tiers en nous appuyant sur notre infrastructure
commerciale bien établie.
Les revenus de notre activité commerciale
croissante contribuent à l'avancement continu de notre portefeuille
de vaccins. Celui-ci comprend le premier vaccin au monde contre le
virus du chikungunya, le seul candidat vaccin contre la maladie de
Lyme en phase avancée de développement clinique, développé en
partenariat avec Pfizer, ainsi que des candidats vaccins contre le
virus Zika et d'autres menaces pour la santé publique mondiale.
| Contacts
Médias et investisseursLaetitia Bachelot-FontaineVP Global
Communications & European Investor RelationsM +33 (0)6 4516
7099laetitia.bachelot-fontaine@valneva.com |
Joshua
Drumm, Ph.D.VP Global Investor RelationsM +001 917 815
4520joshua.drumm@valneva.com |
Information importanteCe
communiqué de presse contient certaines déclarations prospectives
relatives à l'activité de Valneva, notamment en ce qui concerne
l'avancement, le calendrier, les résultats et l'achèvement de la
recherche, du développement et des essais cliniques des produits
candidats, l'approbation réglementaire des produits candidats et la
révision des produits existants. En outre, même si les résultats
réels ou le développement de Valneva sont conformes aux énoncés
prospectifs contenus dans ce communiqué de presse, ces résultats ou
évolutions de Valneva peuvent ne pas être représentatifs du futur.
Dans certains cas, vous pouvez identifier les énoncés prospectifs
par des termes comme “pourrait,” “devrait,” “s'attend à,”
“anticipe,” “anticipe,” “croit,” “a l'intention,” “« estime »”
“vise,” “cible,” ou des mots similaires. Ces énoncés prospectifs
sont basés en grande partie sur les attentes actuelles de Valneva à
la date du présent communiqué et sont assujettis à un certain
nombre de risques et incertitudes connus et inconnus ainsi qu'à
d'autres facteurs qui pourraient faire que les résultats réels, le
rendement ou les réalisations réels diffèrent considérablement des
résultats futurs, des performances ou réalisations futurs, exprimés
ou sous-entendus par ces énoncés prospectifs. En particulier, les
attentes de Valneva pourraient être affectées par, entre autres,
des incertitudes liées au développement et à la fabrication de
vaccins, à des résultats d'essais cliniques inattendus, des actions
réglementaires inattendues ou des retards, à la concurrence en
général, aux fluctuations monétaires, à l'impact de la crise
mondiale et européenne du crédit, à la capacité à obtenir ou à
conserver un brevet ou toute autre protection de propriété
intellectuelle, l'annulation de contrats existants, incluant sans
s'y limiter le contrat d'approvisionnement de HMG, et l'impact de
la pandémie de COVID-19, la survenue de l'un ou l'autre de ces
événements pouvant nuire considérablement à l'activité, à la
situation financière, aux perspectives et aux résultats
d'exploitation de Valneva. Compte tenu de ces risques et
incertitudes, il ne peut y avoir aucune assurance que les énoncés
prospectifs formulés dans le présent communiqué seront
effectivement réalisés. Valneva fournit les informations contenues
dans ce communiqué de presse à la date de celui-ci et décline toute
intention ou obligation de mettre à jour ou de réviser publiquement
tout énoncé prospectif, que ce soit en raison de nouvelles
informations, d'événements futurs ou pour d’autres raisons.
1 Valneva annonce des résultats positifs de Phase 3 concernant
l’immunogénicité de son candidat vaccin contre le chikungunya chez
les adolescents2 Valneva reçoit l’approbation par la U.S. FDA
du premier vaccin au monde contre le chikungunya,
IXCHIQ®3 Valneva Announces U.S. FDA Approval of World’s First
Chikungunya Vaccine, IXCHIQ® - Valneva4 Staples, J.E. Hills, S.L.
Powers, A.M. "Chikungunya." In CDC Yellow Book 2020: Health
Information for International Travel, by Centers for Disease
Control and Prevention. New York: Oxford University Press, 20205
VacZine Analytics Chikungunya virus vaccines Global demand
analysis. February 20206
https://www.who.int/news-room/fact-sheets/detail/chikungunya7
PAHO/WHO data: Number of reported cases of chikungunya fever in the
Americas (Cumulative Cases 2018-2023 and Cases per year 2013-2017).
https://www.paho.org/data/index.php/en/mnu-topics/chikv-en/550-chikv-weekly-en.html.
Last accessed 01 Aug 2023.8 Valneva et l’Institut Butantan signent
un accord final pour un vaccin à dose unique contre le chikungunya
dans les pays à revenus faibles et intermédiaires9 CEPI octroie un
financement à Valneva d’une valeur maximale de $23.4 millions pour
le développement avancé d’un vaccin à injection unique contre le
chikungunya
- 2024_01_10_VLA1553-221_Inititiation_PR_FR_Final
Grafico Azioni Valneva (EU:VLA)
Storico
Da Mar 2024 a Apr 2024
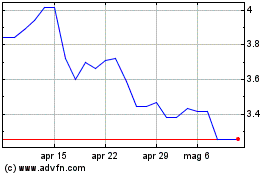
Grafico Azioni Valneva (EU:VLA)
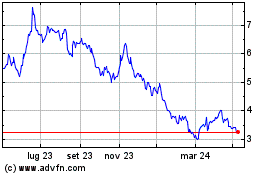
Storico
Da Apr 2023 a Apr 2024